【皓元·技术】一文剖析:探索糖基化在药物偶联中的优势
抗体偶联药物 (Antibody-Drug Conjugate,ADC)是将肿瘤靶向抗体(Tumor Targeted Antibody)和小分子细胞毒性药物(Cytotoxic Drug)利用特定的偶联技术通过连接物(Linker)偶联的一类药物。目前全球获批上市的15款ADC药物,其偶联技术采用传统化学偶联方式,多数为随机偶联产品。使用随机偶联会产生具有不同DAR的ADC的异质混合物,导致ADC药物体内循环半衰期短,有效性降低及脱靶的风险,影响药物整体疗效和剂量[1]。为了解决这一问题,定点偶联技术开始受到人们的关注,当前为人熟知的定点偶联技术包括抗体引入非天然氨基酸,反应性半胱氨酸,各种酶催化技术及糖基化偶联技术[2]。
作为ADC药物的眼睛,抗体药物的活性除了受到抗体序列的影响外,还受到翻译后修饰的影响,其中糖基化修饰是最重要和复杂的修饰之一。作为人血清中含量最高的免疫球蛋白,IgG抗体的N-糖基化位于Fc片段的CH2区的共有序列(Asn-X-Ser/Thr,X可以是除Pro的任意氨基酸残基),寡糖中的GlcNAc与Asn残基上的酰胺氮连接形成N-糖基化,起始于内质网完成于高尔基体。由于抗体糖基化位置主要位于FC端,远离抗体结合Fab端,对其进行修饰偶联对抗原结合活性影响小,因此基于糖基化结构的偶联技术应运而生。如图一所示,Fc聚糖的偶联点位繁多,盐藻糖[3,4],乙酰葡糖胺[5,6],半乳糖[7-10]及唾液酸[11,12]等经过氧化或酶催化,引入特定反应基团,实现毒素分子的定点偶联。目前拥有糖基化偶联技术平台的公司有多家,其中Synaffix,康宁杰瑞,糖岭生物,岩唐生物等公司的糖基化偶联平台为人们所熟知。
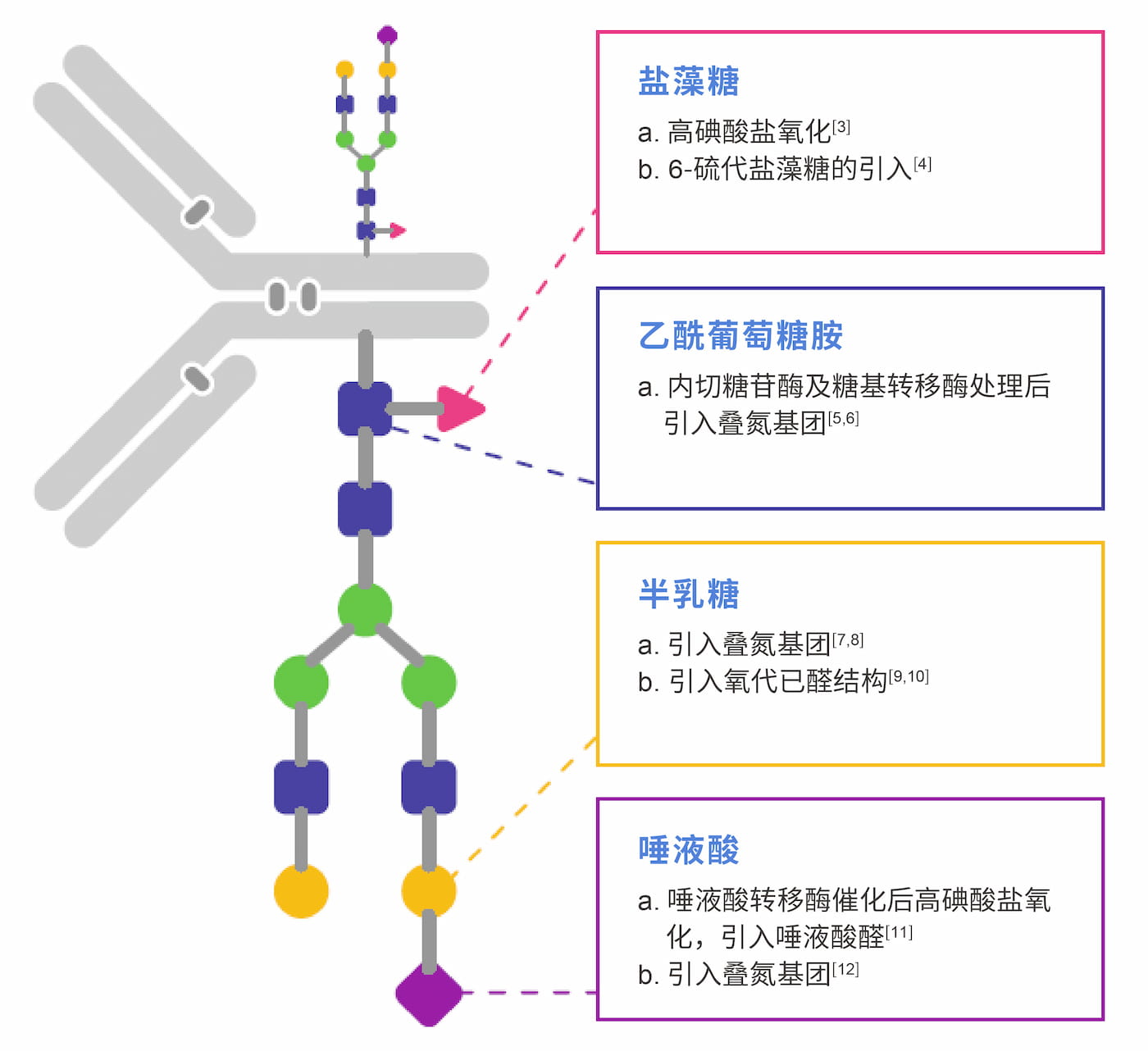
▲ 图1:经典IgG1抗体糖链结构及其可偶联点位[13]
Synaffix的核心平台GlycoConnect™

▲ 图2:GlycoConnect技术示意图[14]
作为N-糖基化偶联技术的先锋,Synaffix的GlycoConnect技术可概况为两酶三步法。首先优化筛选出能够具有优异催化效能的内切糖苷酶Endo-SH,该酶对于抗体N297杂合型、高甘露糖型及复合型糖均有很好的催化效率,抗体糖链经过酶的改造,释放其Core GlcNAc;其次通过筛选得到的野生型糖基转移酶TnGalNAc-T,将带有叠氮基团的linker同第一步释放的抗体Core GlcNAc偶联,最后通过叠氮基团同DBCO的Click反应,实现payload同抗体的定点偶联。同时文献报道,在温和的反应条件下,可以将抗体、Endo-SH酶、带有叠氮基团的linker和TnGalNAc-T同时放入同一个反应体系中,实现两酶两步法。
Synaffix已与超过10家企业展开合作,包括ADC Therapeutics、Mersana Therapeutics和美雅珂,信达等多家药企。通过采用Synaffix平台技术,信达生物的IBI343是全球首款进入三期临床阶段的Claudin18.2 ADC新药,美雅珂的MRG004A 是国内首批获批临床的TF-ADC药物,目前正在中国及美国同时进行临床I/II期研究,并已在胰腺癌、三阴乳腺癌及宫颈癌等适应症中观察到抗肿瘤活性信号。
糖岭生物“DisacLink”糖基化偶联技术
DisacLink技术为糖岭生物开发的第二代糖基化偶联技术(第一代为OligosacLink),如图所示,通过筛选得到的野生型糖苷内切酶Endo-S2,同时兼具水解抗体糖链及转移糖链功能的双功能酶,通过对糖链结构的筛选得到转移效率最佳的二糖底物LacNac-Oxa(2C),同时研究发现在LacNac-Oxa的6号位进行改造并不影响Endo-S2的活性,因此对此位置引入叠氮基团或毒素分子,可以实现一酶两步偶联或一酶一步偶联,极大简化糖基化偶联的工艺步骤,并缩短反应时间,同时因为反应过程不会引入有机溶剂,工艺可开发性强,后续放大生产性强。
利用该方法制备的ADC与同类竞品相比较降低了免疫细胞毒性,保持了FcRn功能。此外,由于较好的亲水性与稳定性,该类ADC具有明显优异的体内活性、药物代谢动力学活性及安全性。目前糖岭生物已同东曜药业就DisacLink™技术达成深度战略合作,双方将开展联合技术攻关,共同开发并持续推进该定点偶联技术的优化与迭代、工艺探索及商业化放大。
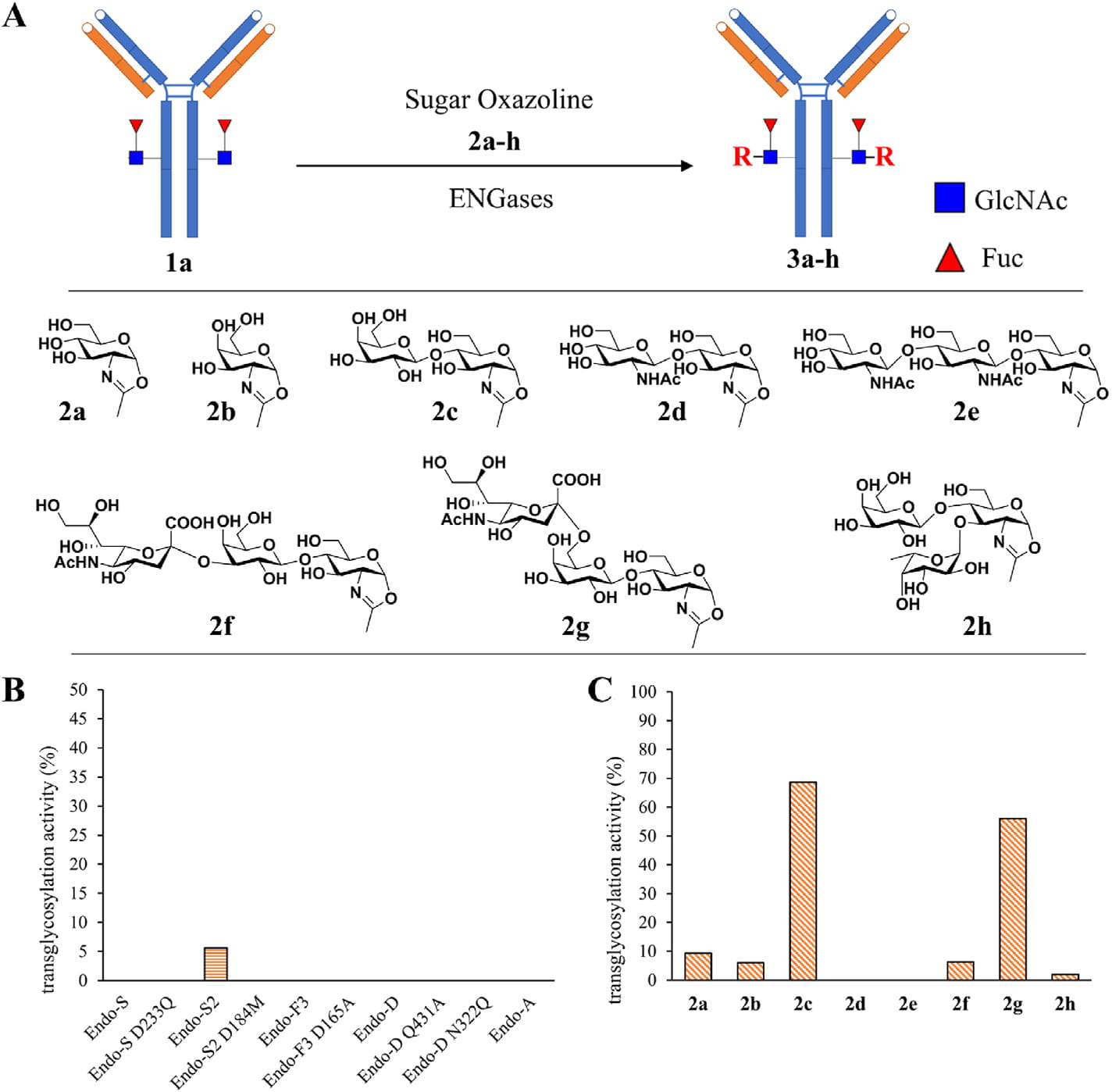
▲ 图3:DisacLink一步法偶联所用Endo酶及linker的筛选[15]
康宁杰瑞的糖基定化点偶联技术平台
康宁杰瑞的糖定点偶联技术平台如下图所示,整体概括为单酶两步法,核心步骤为Step1,即在β-1,4-半乳糖基转移酶的催化作用下,UDP-GalNAz被转移至抗体的末端已酰葡萄糖胺上,从而引入叠氮基团,进而为第二步payload通过点击化学的方法偶联至抗体上。但对于抗体糖链末端的结构如何做到统一(抗体制备过程控制策略),是否需额外修饰,并无太多信息披露。
康宁杰瑞利用其特有的糖定点偶联平台自主研发了新型靶向HER2双表位的抗体偶联药物(ADC)JSKN003(临床III期)和JSKN-016(临床前)。JSKN003是康宁杰瑞基于HER2双抗KN026(anbenitamab)开发的一款ADC药物,目前是全球唯一一款进入III期阶段的HER2双抗ADC。
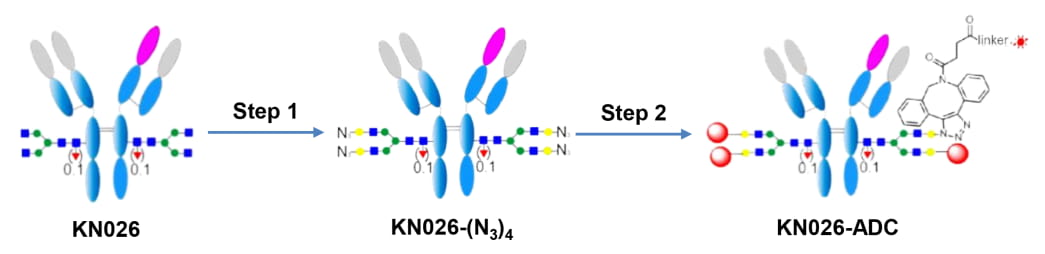
▲ 图4:康宁杰瑞一酶两步法JSKN003[16]
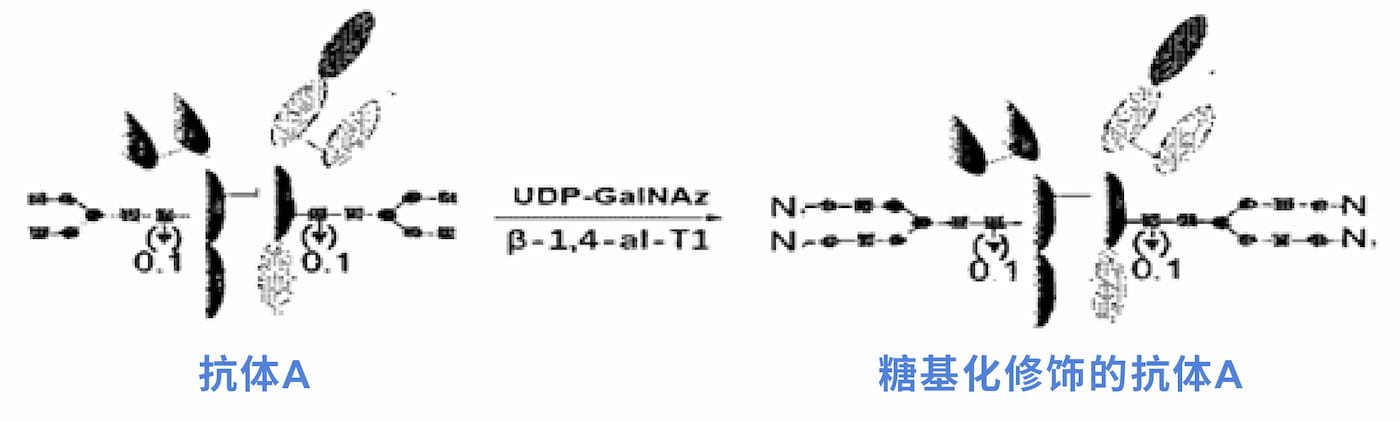
▲ 图5:靶向HER2的双特异性抗体进行糖基化修饰[17]
岩唐生物 YTConju™-岩藻糖基化定点偶联技术平台
已有文献报道的盐藻糖偶联技术有两种,一种是采用高碘酸氧化盐藻糖,进而通过腙键偶联payload,另一种是在细胞培养过程中引入盐藻糖类似物—6硫代盐藻糖,进而类似Thiomab技术偶联payload;同文献报道中的方法不同,根据岩唐生物披露信息,其技术平台通过对抗体Fc区域保守的糖基化位点进行酶化学法改造,并利用高效的岩藻糖基转移酶和改构后的岩藻糖衍生物实现了“一步法”偶联。
利用不同的酶组合方案,在使用同一种岩藻糖衍生物的情况下,该技术平台可分别实现DAR4 (G2F)构型和DAR2(A-LacNAc)构型的抗体偶联物的构建,且获得的抗体偶联物均具有高度均一、亲水以及稳定的特性,并有着出色的体内外药效。
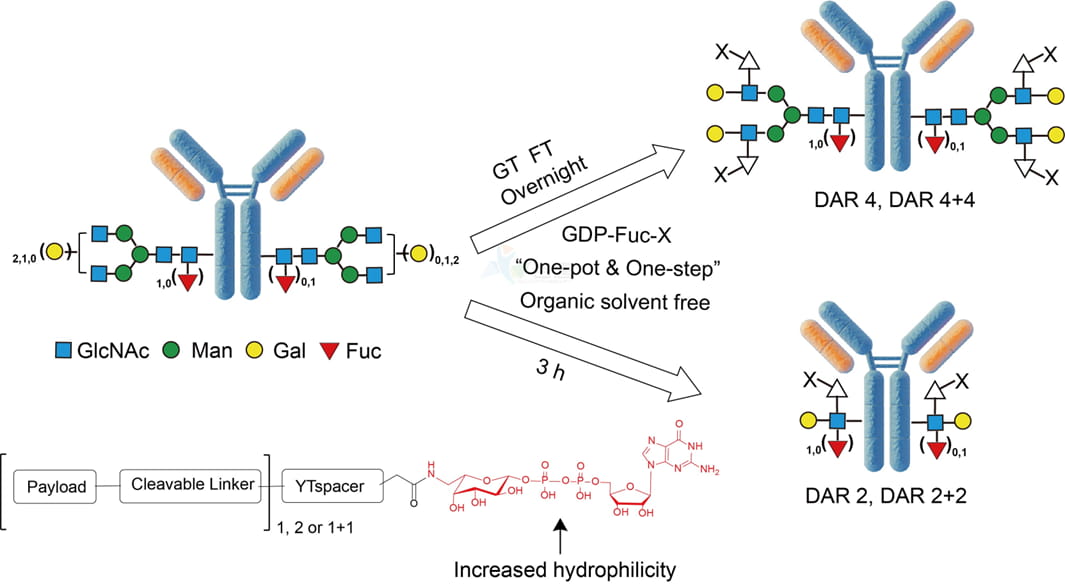
▲ 图6:YTConju™技术平台偶联流程示意图[18]
皓元医药偶联技术工艺平台赋能创新ADC项目开发
皓元医药在ADC小分子领域深耕10余年,拥有经验丰富的技术团队,致力于为国内外客户提供ADC小分子端到端一站式解决方案。目前可提供ADC药物小分子部分CMC&CDMO服务及ADC偶联定制服务。皓元医药ADC偶联技术服务可以按照FFS、FTE、CMC等多种形式,提供偶联药物筛选,偶联工艺开发及优化,偶联样品制备等服务。
皓元医药生物偶联能力
皓元医药依托在毒素—连接子(Payload-Linker)领域的丰富项目经验和专业能力,偶联研发团队在多种生物偶联技术方面积累了丰富经验,涉及不同linker-payload分子和不同的载体分子的偶联,偶联技术包括基于赖氨酸、半胱氨酸的非定点偶联和基于Thiomab、二硫键桥联、酶催化偶联、非天然氨基酸等的定点偶联。

随着万物皆可偶联时代的来临,偶联药物已扩展到ADC以外的多种形式,各式各样的新型药物偶联组合被积极尝试开发,探索新的治疗药物的可能。基于ADC领域多年的积累和深耕,皓元医药搭建了多元的偶联技术工艺平台助力创新XDC项目,包括多种先进的偶联技术,通过整合不同的技术方法,我们可为客户提供更为灵活和可定制的解决方案,为企业XDC管线研发提供有力助推。
参考内容:
[1]Nat Biotechnol, 2008, 26, 925–932
[2]Chudasama V, Maruani A, Caddick S (2016) Recent advances in the construction of antibody–drug conjugates. Nat Chem 8(2):114–119 Nat Chem, 2016, 8, 114-119
[3]Chem Commun, 2012, 48, 7100–7102
[4]Bioconjug Chem, 2013, 24, 1650–1655
[5]Bioconjug Chem, 2015, 26, 2233–2242
[6]Hald A, Nielsen C, MacCann D, Doran N, Morgan H, Buick R, Behrendt N, Engelholm L (2018) Generation of an ADC against sarcoma and glioblastoma. Paper presented at 8th Annual World ADC Europe, Berlin, 26–28 Mar 2018
[7]J Biol Chem, 2002, 277, 20833–20839
[8]Bioconjug Chem, 2009, 20, 1228-36
[9]Mabs, 2014, 6, 1190–1200
[10]Bioconjug Chem, 2013, 24, 1057–1067
[11]Bioconjug Chem, 2014, 25, 510–520
[12]Angew Chem Int Ed Engl, 2014, 53, 7179–7182
[13]Tumey, L. N. . (2020). Antibody-drug conjugates methods and protocols: methods and protocols. Methods in Molecular Biology.
[14]Mabs, 2022, 14, 2078466 Acta Pharmaceutica Sinica B, 2022, 12, 2417-2428.
[15]https://www.alphamabonc.com/technology/large_scale_cmc.html
[16]WO2023280092A1
[17]https://mp.weixin.qq.com/s/2KtIHRAkrhCmudOw1IKs4g

